在辅助生殖技术飞速发展的今天,胚胎质量评估始终是决定体外受精 – 胚胎移植(IVF-ET)成功率的关键环节。长期以来,临床医生主要依靠基于二维(2D)显微镜成像的 Gardner 评分系统判断囊胚质量,但这种方法存在主观性强、难以捕捉胚胎立体结构等固有缺陷。近日,华中科技大学同济医学院附属同济医院等机构的研究团队在《npj Digital Medicine》期刊发表重要成果,开发出一种无创、兼容临床流程的囊胚 3D 重建技术,为胚胎评估提供了更客观、精准的新方案。

传统胚胎评估的困境与挑战
囊胚移植因着床率高已成为辅助生殖的主流策略,而胚胎质量的精准判断直接关系到妊娠结局。目前广泛使用的 Gardner 评分系统通过观察囊胚的内细胞团(ICM)、滋养外胚层(TE)形态及扩张程度进行分级,但这种人工评估方式存在明显局限。
研究数据显示,10 位来自不同诊所的胚胎学家对完全囊胚的 ICM 分级一致性仅为中等水平(Kappa=0.349),TE 分级的一致性同样不理想(Kappa=0.397)。这意味着不同医生对同一胚胎的评估可能存在较大差异,主观性误差难以避免。更重要的是,2D 成像只能捕捉胚胎的局部切面信息,ICM 和 TE 的形态特征会因成像角度不同而产生差异,进一步影响评估准确性。尽管 3D 重建技术已被证实能更全面地评估胚胎形态,但现有方法或需要荧光标记造成胚胎损伤,或需要复杂操作干扰培养环境,难以整合到常规临床流程中。开发一种无创、高效且与临床工作流兼容的 3D 评估方法,成为辅助生殖领域的迫切需求。

创新技术:无创 3D 重建
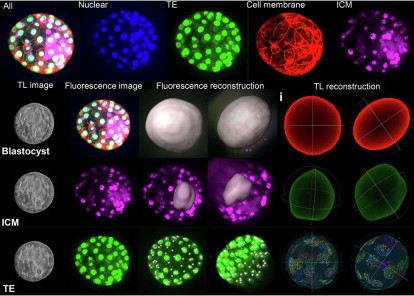
针对传统技术的痛点,研究团队开发了一种基于延时成像(TL)系统和人工智能(AI)算法的囊胚 3D 重建方法,该技术的核心流程简洁高效,完全依托临床常规设备。研究团队收集了 2025 个冷冻解冻胚胎移植(FET)周期的囊胚数据,每个囊胚对应 11 个焦平面的成像数据。由于原始焦平面数量有限,团队采用基于生成对抗网络(GAN)的插值算法,将 11 个焦平面扩展至 81 个,有效弥补了垂直分辨率不足的问题,为精准重建提供了充足数据支撑。

在图像分割环节,研究采用 UNet++ 深度学习模型,对囊胚的 ICM 和 TE 进行高精度语义分割。所有图像均由两位拥有 15 年以上经验的资深胚胎学家按照专家共识完成标注审核,团队通过图像增强技术提升细胞边缘清晰度,最终实现了优异的分割效果 ——ICM 分割训练集准确率达 0.679,TE 分割训练集准确率更是高达 0.797。3D 重建过程分为几何结构重建和纹理特征重建两部分,通过提取 ICM 和 TE 的边界轮廓构建点云模型,再经表面重建形成网格几何结构,同时融合多焦平面纹理信息生成完整的 3D 模型。
为验证重建准确性,研究团队选取 26 个囊胚进行荧光染色,通过共聚焦显微镜重建作为 “金标准” 对照。结果显示,该技术重建的核心参数相对误差极低:囊胚表面积误差仅 2.13%±1.63%,直径误差 1.98%±1.32%,TE 细胞数误差 10.00%±8.73%,充分证明了方法的可靠性。

关键发现:关联妊娠的3D 参数
研究团队成功量化了 20 项囊胚 3D 形态参数,涵盖囊胚整体形态、TE 相关特征、ICM 相关特征及 ICM-TE 空间关系四大类别,并系统分析了这些参数与临床妊娠、活产、流产等结局的关联。
数据分析发现,多项 3D 参数与妊娠和活产结果显著相关。其中,囊胚的表面积、体积、直径和囊胚腔体积越大,同时表面积 / 体积比越小,妊娠和活产的概率越高(P<0.001);TE 的表面积、体积、细胞数和密度等指标也与妊娠结局密切相关,数值越大预示着胚胎发育潜力越好(P<0.001)。在 ICM 相关参数中,形状因子成为预测妊娠结局的关键指标 —— 形状因子越小(即 ICM 越接近球形),临床妊娠和活产的成功率越高(P<0.05)。此外,ICM 与 TE 之间的空间距离越大、ICM 体积占囊胚体积的比例越小,也更有利于妊娠成功(P<0.05)。而 ICM 表面积 / 体积比越大、ICM 象限内 TE 细胞数及比例越高,则流产风险显著增加(P<0.05)。
值得注意的是,该技术能够有效区分传统评分系统中难以鉴别的胚胎。在研究纳入的 2025 个囊胚中,4BB 级囊胚占比高达 43.7%(885 个),传统方法无法进一步区分其发育潜力。但 3D 参数分析显示,其中 TE 表面积、TE 体积与妊娠显著相关,囊胚体积、表面积 / 体积比与活产显著相关(P<0.05),这意味着该技术可帮助医生在相似分级的胚胎中筛选出更具发育潜力的个体。研究还发现,雌性胚胎和雄性胚胎的 ICM 3D 形态存在显著差异(P<0.05),雌性胚胎的 ICM 相对更大且更接近球形,这为胚胎发育机制的深入研究提供了新的视角。

临床价值与未来展望
这项创新技术为辅助生殖领域带来了多重临床价值。它突破了传统 2D 评估的主观性局限,通过量化的 3D 参数提供客观统一的评估标准,有助于减少不同医生间的判断差异,提升胚胎选择的一致性和准确性。同时,该技术无需改变现有临床流程,可直接整合到常规胚胎培养和评估中,医疗机构无需额外投入大量资源即可推广应用。
对于患者而言,3D 评估能够提供更全面的胚胎质量信息,帮助医生筛选出最具发育潜力的胚胎进行移植,从而提高妊娠成功率,减少反复移植带来的身心负担和经济损失。可视化的 3D 模型也能让患者更直观地了解胚胎状况,改善医患沟通,增强治疗信心。在学术层面,该研究基于 2025 个囊胚的大样本数据,实现了囊胚全流程 3D 重建及大规模 3D 形态参数量化,提出了 ICM 形状因子、ICM-TE 空间距离等新型预测指标,为胚胎发育机制研究提供了重要数据支撑。
当然,研究也存在一定局限性。纳入的囊胚均来自 FET 周期,以高质量胚胎为主,低质量囊胚样本相对不足;TL 设备的成像范围限制可能导致部分囊胚无法完整成像,影响重建准确性。未来,研究团队将进一步优化技术,扩大样本量,尤其是增加低质量囊胚的研究数据,同时探索与其他胚胎评估指标的结合,如胚胎动力学参数等,以进一步提升预测精度。
随着技术的不断完善,这种 AI 驱动的囊胚 3D 重建技术有望成为辅助生殖领域的标准化评估工具,推动胚胎选择向更精准、更客观、更自动化的方向发展。相信在不久的将来,这项技术将广泛应用于临床实践,为更多不孕不育家庭带来生育希望,助力辅助生殖技术迈上新台阶。
Huang B, Si K, Guo Y, Wang X, Zhou W, Ma B, Ren X, Wu L, Yue J, Wang J, Shi Z, Jin L. Timelapse-based 3D reconstruction of blastocysts reveals 3D morphologies of human blastocysts. NPJ Digit Med. 2025 Nov 17;8(1):671. doi: 10.1038/s41746-025-02028-9. PMID: 41249434; PMCID: PMC12623974.